Đề xuất thành lập sàn giao dịch hồ tiêu vẫn đang được các bộ ngành cân nhắc

Tình hình nhập khẩu dược phẩm 4 tháng 2016
| Trị giá (USD) | So sánh +/- (%) với tháng trước |
Tháng 1 | 197.172.691 | -14,5 |
Tháng 2 | 177.530.137 | -10,0 |
Tháng 3 | 200.929.160 | +13,2 |
Tháng 4 | 215.238.119 | +7,1 |
(Nguồn số liệu: TCHQ)
Việt Nam nhập khẩu dược phẩm từ 29 quốc gia trên thế giới, trong đó chủ yếu từ Ấn Độ chiếm 11,6% tổng kim ngạch, đạt 91,9 triệu USD, tăng 22,54%. Đứng thứ hai về kim ngạch là thị trường Pháp, đạt 90,5 triệu USD, tăng 3,07%, kế đến là Đức 64,3 triệu USD, tăng 14,13%...
Nhìn chung, 4 tháng đầu năm nay, nhập khẩu dược phẩm đều tăng trưởng kim ngạch ở các thị trường, số thị trường với tốc độ tăng trưởng dương chiếm tới 82,7%, trong đó nhập khẩu từ Philippine tăng mạnh vượt trội, tuy kim ngạch chỉ đạt 3,6 triệu USD, nhưng tăng 202,78%, kế đến là Indonesia, tăng 163,61%, đạt 16,6 triệu USD. Ngược lại, số thị trường với tốc độ tăng trưởng âm chỉ chiếm 17,2% trong đó nhập từ Nga giảm mạnh nhất, giảm 64,92%, kế đến Achentina giảm 36,67%, Singapore 27,91% Canada, Đan Mạch giảm lần lượt 24,71% và 12,10%.
Thống kê sơ bộ của TCHQ về thị trường nhập khẩu dược phẩm 4 tháng 2016
ĐVT: USD
Thị trường | 4 tháng 2016 | 4 tháng 2015 | So sánh +/- (%) |
Tổng cộng | 791.370.844 | 635.139.659 | 24,60 |
Ấn Độ | 91.941.054 | 75.031.116 | 22,54 |
Pháp | 90.580.892 | 87.882.631 | 3,07 |
Đức | 64.318.089 | 56.354.597 | 14,13 |
Hàn Quốc | 63.039.470 | 50.941.142 | 23,75 |
Italia | 60.907.902 | 41.628.010 | 46,31 |
Hoa Kỳ | 45.610.449 | 25.444.289 | 79,26 |
Anh | 44.996.182 | 33.010.615 | 36,31 |
Thuỵ Sỹ | 31.160.740 | 30.649.369 | 1,67 |
Bỉ | 26.651.009 | 21.250.422 | 25,41 |
Thái Lan | 24.949.247 | 18.943.705 | 31,70 |
Tây Ban Nha | 18.158.614 | 12.591.875 | 44,21 |
Indonesia | 16.654.915 | 6.318.064 | 163,61 |
Oxtrâylia | 15.994.720 | 14.603.246 | 9,53 |
Trung Quốc | 15.461.111 | 13.494.599 | 14,57 |
Áo | 14.993.766 | 12.571.685 | 19,27 |
Ba Lan | 12.456.252 | 11.457.793 | 8,71 |
Thuỵ Điển | 12.142.536 | 11.160.942 | 8,79 |
Nhật Bản | 10.306.881 | 6.361.636 | 62,02 |
Hà Lan | 9.905.217 | 5.820.655 | 70,17 |
Đan Mạch | 7.060.024 | 8.031.915 | -12,10 |
Đài Loan | 5.156.491 | 4.263.475 | 20,95 |
Thổ Nhĩ Kỳ | 4.923.953 | 3.922.172 | 25,54 |
Malaixia | 4.887.198 | 3.776.994 | 29,39 |
Singapore | 4.235.954 | 5.875.559 | -27,91 |
Philippin | 3.684.202 | 1.216.777 | 202,78 |
Achentina | 3.245.396 | 5.124.926 | -36,67 |
Canada | 1.932.816 | 2.567.268 | -24,71 |
Nga | 245.582 | 700.064 | -64,92 |
Ailen | 18.196.349 | 12.081.940 |
|
Dẫn nguồn tin từ phunuonline.com.vn ra ngày 25/12/2015, ngày 7/12/2015, ông Trương Quốc Cường, Cục Quản lý dược, Bộ Y tế gửi công văn số 22721/QLD-CL đến các cơ sở y tế công bố rút thêm tên Công ty Celogen Pharma Pvt., Ltd (Ấn Độ) và Công ty Amherst Laboratories Inc (Philippines) ra khỏi danh sách các công ty nước ngoài có thuốc vi phạm chất lượng, vì theo Cục này, sau 6-12 tháng kiểm tra 100% lô thuốc nhập khẩu của hai công ty trên, đã không có lô thuốc nào vi phạm chất lượng. Như vậy tính từ 2013 đến nay, Cục Quản lý dược đã cho phép 44 công ty của 10 quốc gia từng đưa thuốc không đạt chất lượng vào Việt Nam bán cho người tiêu dùng không cần kiểm tra 100% chất lượng thuốc nhập khẩu.
Trước tình trạng thuốc ngoại nhập khẩu kém chất lượng, tại dự thảo Nghị định quy định điều kiện kinh doanh thuốc, Bộ Y tế đã đề xuất quy định về điều kiện và phạm vi của tổ chức, cá nhân tham gia xuất khẩu, nhập khẩu thuốc, bao bì tiếp xúc trực tiếp với thuốc.
Theo dự thảo đối với thương nhân là doanh nghiệp Việt Nam, doanh nghiệp có Giấy chứng nhận đủ điều kiện kinh doanh thuốc phạm vi nhập khẩu thuốc được nhập khẩu trực tiếp và nhận uỷ thác nhập khẩu thuốc thành phẩm, nguyên liệu làm thuốc, vắc xin, sinh phẩm y tế, thuốc từ dược liệu, thuốc đông y, thuốc phóng xạ được miễn trừ khai báo, cấp phép phù hợp với phạm vi kinh doanh ghi trong Giấy chứng nhận đủ điều kiện kinh doanh thuốc và giấy chứng nhận GSP (Thực hành tốt bảo quản thuốc).
Bên cạnh đó, doanh nghiệp có Giấy chứng nhận đủ điều kiện kinh doanh thuốc và có giấy chứng nhận đạt tiêu chuẩn “Thực hành tốt sản xuất thuốc” (GMP) được nhập khẩu nguyên liệu để sản xuất thuốc của chính doanh nghiệp và bán cho các doanh nghiệp sản xuất thuốc khác.
Doanh nghiệp sản xuất có Giấy chứng nhận đủ điều kiện kinh doanh thuốc từ dược liệu được nhập khẩu dược liệu để phục vụ nhu cầu sản xuất của chính doanh nghiệp và bán cho các cơ sở sản xuất thuốc khác, các cơ sở khám chữa bệnh đông y. Doanh nghiệp có Giấy chứng nhận đủ điều kiện kinh doanh thuốc và có Giấy phép tiến hành các công việc bức xạ do cơ quan có thẩm quyền cấp còn hiệu lực được nhập khẩu trực tiếp thuốc phóng xạ không được miễn trừ khai báo, cấp phép.
Đối với thương nhân là doanh nghiệp có vốn đầu tư trực tiếp nước ngoài tại Việt Nam có Giấy chứng nhận đủ điều kiện kinh doanh thuốc (phạm vi sản xuất thuốc) được nhập khẩu nguyên liệu để phục vụ sản xuất thuốc của chính doanh nghiệp. Các hoạt động xuất khẩu, nhập khẩu thuốc không phục vụ sản xuất thuốc của doanh nghiệp sẽ được Bộ Y tế hướng dẫn tại văn bản khác.
Theo dự thảo, thương nhân Việt Nam có Giấy chứng nhận đủ điều kiện kinh doanh thuốc được xuất khẩu, ủy thác xuất khẩu, nhận ủy thác xuất khẩu thuốc, trừ thuốc gây nghiện, thuốc hướng tâm thần, tiền chất dùng làm thuốc và thuốc phóng xạ.
Thương nhân được phép ủy thác nhập khẩu thuốc theo đúng phạm vi hoạt động quy định tại Giấy chứng nhận đủ điều kiện kinh doanh thuốc, trừ thuốc gây nghiện, thuốc hướng tâm thần, tiền chất dùng làm thuốc và thuốc phóng xạ.
Dự thảo nêu rõ, các tổ chức, cá nhân không phải là thương nhân trên cơ sở hợp đồng được ký kết theo quy định của pháp luật, được ủy thác xuất khẩu, ủy thác nhập khẩu thuốc phục vụ nhu cầu sử dụng của chính tổ chức, cá nhân đó, trừ thuốc gây nghiện, thuốc hướng tâm thần, tiền chất dùng làm thuốc và thuốc phóng xạ.
Văn phòng đại diện của các thương nhân nước ngoài có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam, các thương nhân Việt Nam có Giấy chứng nhận đủ điều kiện kinh doanh thuốc được phép nhập khẩu thuốc phục vụ công tác đăng ký lưu hành (bao gồm cả các thuốc để kiểm nghiệm, kiểm định theo yêu cầu của việc đăng ký thuốc). Các cơ sở có chức năng nghiên cứu, kiểm nghiệm, cơ sở sản xuất thuốc được phép nhập khẩu thuốc phục vụ công tác nghiên cứu, kiểm nghiệm. Các cơ sở khám bệnh, chữa bệnh của các tỉnh, thành phố, y tế ngành và các tổ chức của Việt Nam được phép nhận thuốc viện trợ từ các tổ chức từ thiện, tổ chức phi Chính phủ, cá nhân người nước ngoài, người Việt Nam ở nước ngoài gửi tặng, viện trợ và chịu trách nhiệm về sử dụng thuốc hiệu quả an toàn, hợp lý, đúng mục đích viện trợ. Tổ chức, cá nhân có thuốc thử lâm sàng được nhập khẩu thuốc để phục vụ việc thử lâm sàng theo đề cương nghiên cứu thử thuốc trên lâm sàng đã được Bộ Y tế phê duyệt. Tổ chức, cá nhân có đề cương nghiên cứu sinh khả dụng, tương đương sinh học đã được phê duyệt tại cơ quan kỹ thuật chuyên ngành do Bộ Y tế ủy quyền được nhập khẩu thuốc để phục vụ việc nghiên cứu sinh khả dụng, tương đương sinh học.
Thương nhân được phép nhập khẩu, xuất khẩu bao bì tiếp xúc trực tiếp với thuốc.
Đối với thương nhân nước ngoài cung cấp thuốc vào Việt Nam, theo dự thảo, thương nhân nước ngoài cung cấp thuốc, dược liệu, thuốc từ dược liệu, thuốc đông y vào Việt Nam phải là doanh nghiệp có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam. Thương nhân nước ngoài cung cấp tá dược, bao bì tiếp xúc trực tiếp với thuốc và cung cấp thuốc, nguyên liệu làm thuốc theo trường hợp (1) không bắt buộc phải là các doanh nghiệp có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam.
Trường hợp các thuốc cần cho nhu cầu phòng, điều trị bệnh và nguyên liệu cần cho nhu cầu sản xuất thuốc trong nước nhưng các doanh nghiệp có Giấy phép hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam không cung cấp hoặc cung cấp không đủ nhu cầu, Cục Quản lý dược - Bộ Y tế xem xét, quyết định cho phép nhập khẩu từ các doanh nghiệp cung cấp thuốc có uy tín trên thế giới.
Nguồn: VITIC/chinhphu.vn
 1
1Đề xuất thành lập sàn giao dịch hồ tiêu vẫn đang được các bộ ngành cân nhắc
 2
2Sau một thời gian giảm sâu, giá cà phê Việt Nam đang có dấu hiệu phục hồi và liên tục tăng trở lại trong các tháng 3, 4 và 5/2016.
 3
3Hàng xuất khẩu của Việt Nam sang Mỹ đã có sự chuyển dịch từ sản phẩm thô sang chế biến sâu.
 4
4Bộ Tài chính vừa dự thảo Thông tư sửa đổi, bổ sung thuế nhập khẩu một số mặt hàng linh kiện, phụ tùng ô tô. Theo đó, thuế nhập khẩu 19 dòng linh kiện, phụ tùng ô tô có thể tăng kịch trần.
 5
54 tháng đầu năm 2016, xuất khẩu rau quả đạt 764 triệu USD, tăng mạnh so với cùng kỳ năm ngoái (47,7%). Hết tháng 5, kim ngạch xuất khẩu mặt hàng này đạt hơn 900 triệu USD.
 6
6Theo Bộ Nông nghiệp và Phát triển nông thôn, khối lượng gạo xuất khẩu tháng 5 năm 2016 ước đạt 345 nghìn tấn với giá trị đạt 165 triệu USD, đưa khối lượng xuất khẩu gạo 5 tháng đầu năm 2016 ước đạt 2,35 triệu tấn và 1,06 triệu USD, giảm 2,1% về khối lượng nhưng tăng 1,2% về giá trị so với cùng kỳ năm 2015.
 7
7Tính chung từ đầu năm cho đến hết tháng 4/2016, Việt Nam đã xuất khẩu 1,6 triệu tấn sắn và sản phẩm, trị giá 427,7 triệu USD, giảm 12,57% về lượng và giảm 26,17% về trị giá so với cùng kỳ.
 8
8Theo số liệu thống kê sơ bộ của Tổng cục Hải quan, trong 4 tháng năm 2016, Việt Nam nhập khẩu hàng hóa từ thị trường Trung Quốc trị giá 14,73 tỷ USD, giảm 3,67% so với cùng kỳ năm ngoái; trong khi xuất khẩu sang Trung Quốc đạt 5,8 tỷ USD, tăng tới 16,5%.
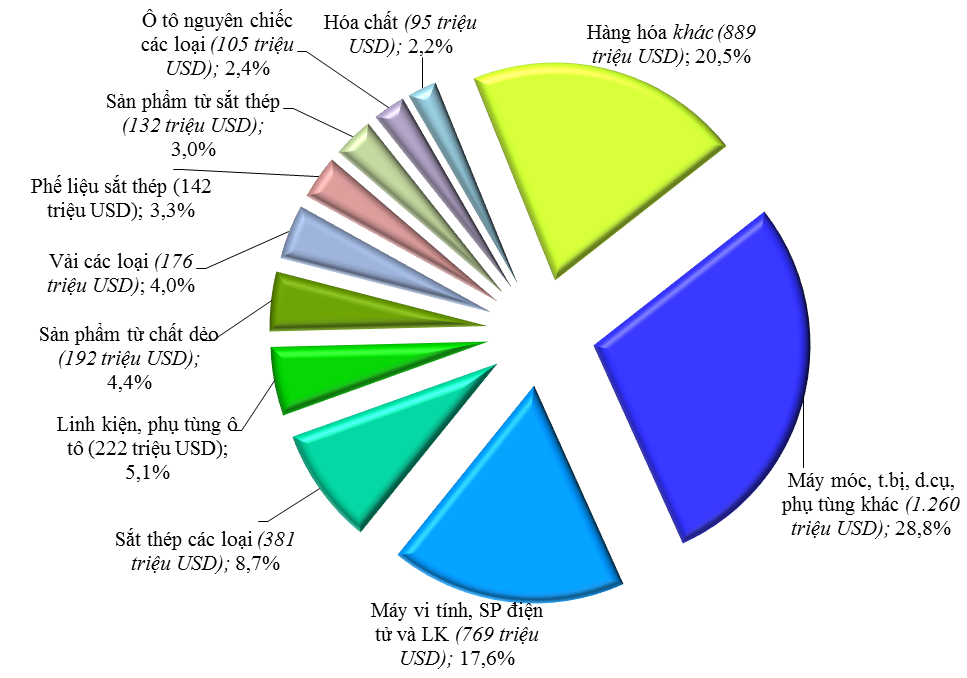 9
9Theo Tổng cục Hải quan, xuất khẩu hàng hóa của Việt Nam sang Nhật Bản có sự tăng trưởng mạnh mẽ trong 10 năm trở lại đây. Theo đó, nếu năm 2006 chỉ đạt kim ngạch 5,23 tỷ USD đến năm 2015 là 14,13 tỷ USD, đạt mức tăng trưởng bình quân 14,1%/năm.
 10
10“Câu lạc bộ” các mặt hàng xuất khẩu đạt từ 1 tỷ USD trở lên đã gia tăng qua các năm. Năm 2016 mới qua 5 tháng đã có 12 mặt hàng đạt từ 1 tỷ USD trở lên.
Kinh tế vĩ mô
Kinh tế Thế giới
Nông lâm thủy sản
Hàng hóa
Thông tin ngành
Chính khách - Yếu nhân
Quân sự - Chiến sự